澳門大學健康科學學院助理教授代雲路帶領的研究團隊成功研發新型納米藥物,能高效抑制黑色素瘤的轉移及促進抗腫瘤免疫反應。該納米藥物能顯著地抑制腫瘤生長並激活長久的特異免疫記憶,為下一代癌症免疫療法帶來新希望。相關研究成果已獲全球著名學術期刊《自然通訊》(Nature Communications)刊登。
腫瘤細胞可以引致全身免疫系統失調而進行快速擴張,除了上調細胞表面程序性死亡配體 1 (PD-L1) 的表達外,腫瘤細胞(例如黑色素瘤)會在外泌體表面表達高水平的 PD-L1配體,以抑制全身的抗腫瘤免疫反應。
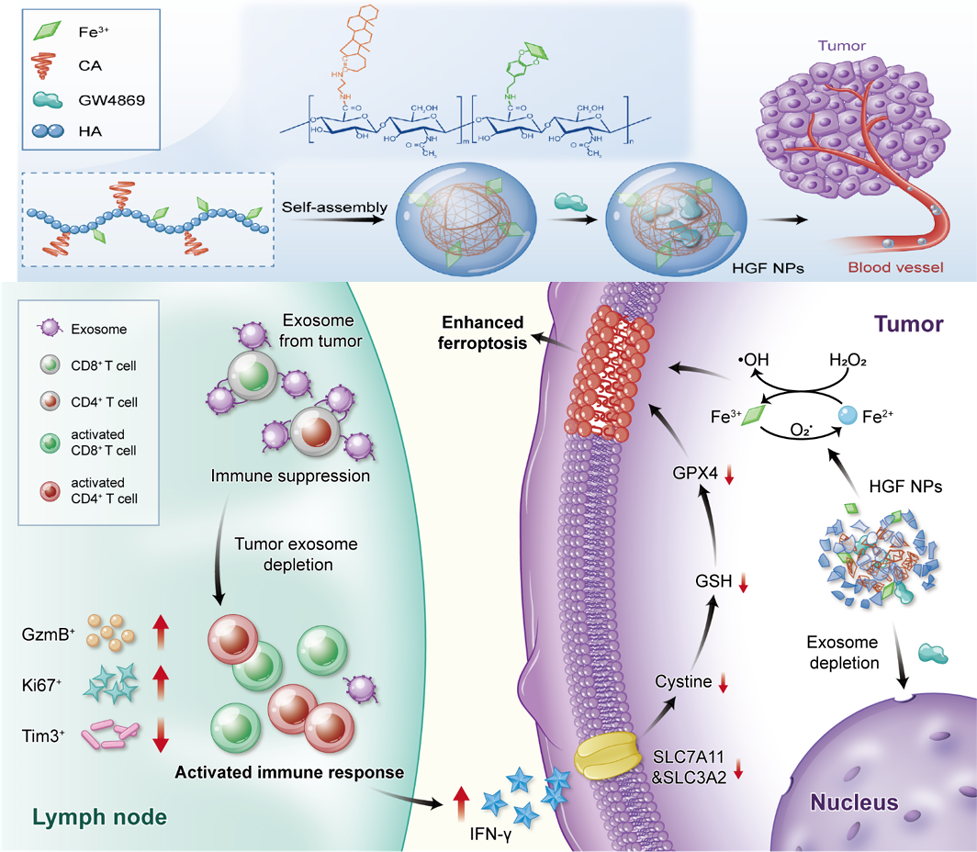
澳大研究團隊開發了一種兩親性的金屬多酚配位透明質酸納米藥物:HACA-Fe@GW4869納米顆粒(HGF NPs)。
(圖片來源:澳門大學)
研究結果證明HGF NPs可靶向CD44受體表達的黑色素瘤細胞,減少腫瘤源性外泌體的分泌,進而削弱外泌體PD-L1的免疫抑製作用。免疫T細胞得以激活並分泌大量干擾素-γ細胞因子,從而抑制癌細胞表面的胱氨酸/谷氨酸轉運蛋白表達:SLC7A11 和 SLC3A2。兩者在維持細胞攝取胱氨酸和谷氨酸以進行抗氧化方面發揮關鍵作用,其下調可以增強細胞內的脂質過氧化作用進而引發鐵死亡。
與此同時,由 HGF NPs 釋放的鐵離子進一步增強癌細胞內的鐵死亡。在多種黑色素瘤動物模型中實驗發現,HGF NPs成功地抑制腫瘤生長並激活長久的特異免疫記憶。此外,HGF NPs 治療在結合PD-L1 檢查位點阻斷治療後,可進一步抑制黑色素瘤的轉移及促進抗腫瘤免疫反應,這種聯合治療策略為下一代癌症免疫療法提供了新方向。
是次研究的通訊作者為代雲路,其博士生王國浩、博士後謝麗斯和李蓓為共同第一作者,博士後李傑及博士生桑瑋、顏潔、田浩、李文曦、張展和田野亦對該研究作出重要貢獻。該項研究由澳門特別行政區科學技術發展基金(檔案編號:0109/2018/A3 和0011/2019 /AKP)、澳門大學(檔案編號:SRG2018-00130-FHS)及深港澳科技計劃(檔案編號:SGDX20201103093600004)資助。研究文章的完整版本可瀏覽:https://www.nature.com/articles/s41467-021-25990-w

(圖片來源:澳門大學)