近年來, 活細胞 因為其高度生物相容性,長循環和特定組織的富集作用,在作為藥物載體受到越來越多的關注。
由於細胞載體製劑的體外製備涉及複雜耗時的內源性細胞的提取和分選,且細胞處理過程也容易引起細胞損傷和污染;另外基於細胞的藥物載體也常常因外排作用會導致藥物提前洩露,並且在應用於不同個體時會有免疫排異反應,因此開發一種適宜的細胞藥物載體的體內構建方法至關重要。
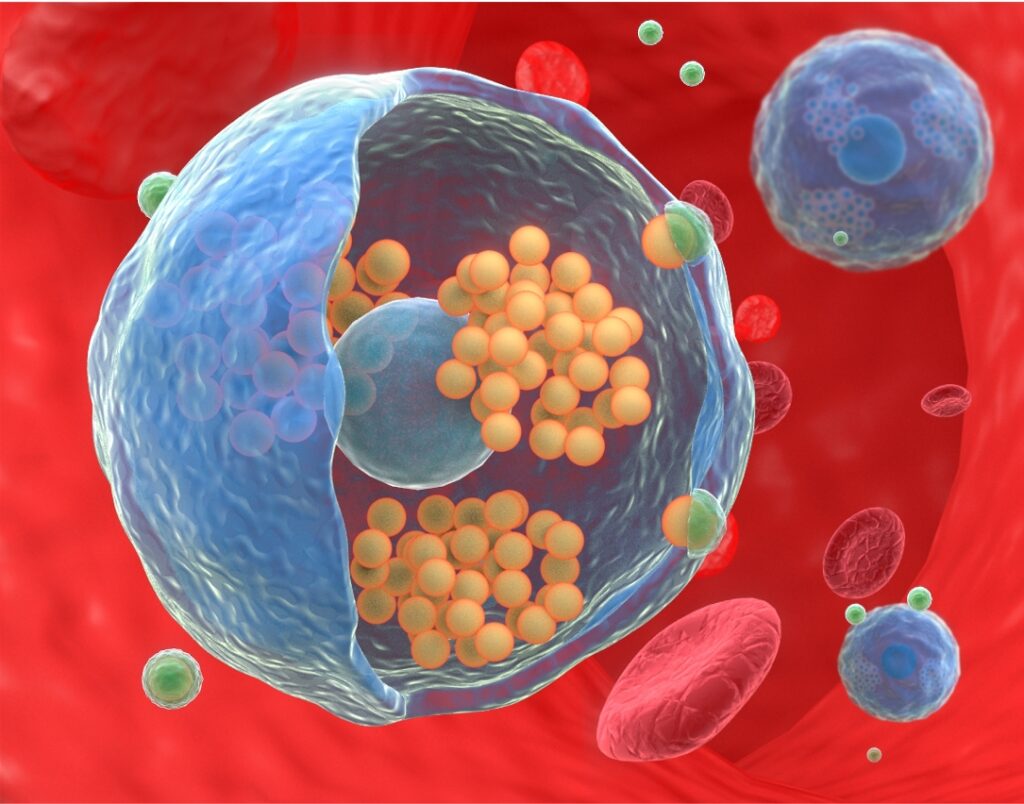
有見及此,澳門大學中華醫藥研究院副教授王瑞兵的研究團隊開發了大腸桿菌外膜囊泡包被的超分子納米粒前體作為細菌仿生納米藥物,可靶向治療實體瘤。該研究成果已刊登於國際頂級綜合性學術期刊《科學進展》(Science Advances)。
(圖片來源:澳門大學)
該項研究獨特地提出“體內搭載免疫細胞並胞內組裝搭便車及光熱治療增強的內應式靶向給藥”策略,成功開發一種細菌外膜囊泡包被的超分子納米粒前體作為細菌仿生納米藥物,體內特異性被免疫細胞識別,並實現主客體作用介導的胞內納米粒的超分子組裝聚集以減少藥物的外排。
研究結果證實體內構築的免疫細胞載體可響應實體瘤(如黑色素瘤)的炎性特點,實現胞內納米粒聚集體的內應式靶向遞送,而初始光熱治療增強的腫瘤炎症信號可進一步招募免疫細胞,促進納米粒聚集體的腫瘤富集,增強光熱治療誘導的抗腫瘤免疫療效,有高效治療實體瘤的潛力。
相關研究成果以“細菌仿生納米藥物介導的免疫細胞內組裝體的構建及其搭便車式靶向抗腫瘤免疫治療”為題發表於全球學術界知名期刊《科學進展》。

(圖片來源:澳門大學)
該論文通訊作者為王瑞兵,共同通訊作者為澳大中華醫藥研究院特聘教授李銘源,博士後高成和碩士生王慶福為文章共同第一作者;澳大博士生李俊燕和鄺熙婷、研究助理韋健文、博士後謝貝貝等人也對此研究作出重要貢獻。
*研究全文可瀏覽:
https://www.science.org/doi/10.1126/sciadv.abn1805